![]() 《常见的金属和盐》测试
《常见的金属和盐》测试
1、单选题(每小题只有一个正确答案)
1.现有甲、乙、丙、丁四种颗粒大小相同的金属,分别投入相同的稀硫酸中,只有甲、乙表面有气泡产生,且乙产生气泡较快;再把都经过打磨后的丙和丁投入相同的硝酸银溶液中,过一会儿,丙的表面有银析出,而丁没变化,则四种金属的活动性由强到弱顺序是
A.丙>乙>丁>甲 B.乙>甲>丙>丁 C.甲>乙>丙>丁 D.乙>甲>丁>丙
2.某同学梳理总结了以下要点:①蜡烛吹灭的原理是隔绝了氧气;②红磷在空气中燃烧产生很多白烟,放热;③“粗盐中难溶性杂质的去除”的实验中,当蒸发皿中出现较多固体时,停止加热;④防毒面具的原理是借助活性炭的强吸附性;⑤氢氧化钠、氢氧化钙都是碱,都易潮解且与空气中CO2反应而变质;⑥胃酸过多可以适当服用含氢氧化镁或苏打的药物。其中正确的组合是
A.①②④⑤ B.②③④ C.②③④⑥ D.②④⑥
3.碳酸氢钠在生产、日常有着广泛的作用。碳酸氢钠的俗称是()
A.纯碱 B.苏打 C.熟石灰 D.小苏打
4.除去铜粉中混有些少量氧化铜,其主要操作过程是
A.加适当水,加热,过滤,洗涤 B.加大热或在空气中灼热
C.加入过量稀H2SO4微热后,过滤,洗涤 D.加足量的AgNO3,过滤,洗涤
5.下列做法正确的是()
A.假如发现火险或遇失火,应立即拨打119火警电话
B.在自行车链条上镀铬,预防自行车链条生锈
C.当燃气灶火焰呈现黄色,锅底出现黑色时,调节进风口,使进风量增大
D.为预防大米霉变,应将大米保存在密封干燥处
6.下列实验策略能达到实验目的的是( )
选项 | 实验目的 | 实验策略 |
A | 辨别氯化铵与硫酸铵固体 | 取样,分别与熟石灰混合研磨,闻气味 |
B | 辨别硬水和软水 | 察看颜色或闻气味 |
C | 除去NaOH溶液中少量的Na2CO3 | 加入适当的石灰水,过滤 |
D | 除去CaO中少量CaCO3 | 加入适当的水,过滤 |
A.A B.B C.C D.D
7.化学学习小组做实验时记录了下列实验现象,其中正确的是()
A.细铁丝在空气中剧烈燃烧,火星四射,有黑色固体生成
B.红磷在空气中燃烧,产生很多白色烟雾
C.木炭在氧气中燃烧,发出白光,生成二氧化碳气体
D.向氢氧化钠溶液中滴加硫酸铜溶液,产生蓝色沉淀
8.下列实验办法能达到实验目的的是
选项 | 实验目的 | 实验办法 |
A | 检验一瓶O2是不是采集满 | 将带火星的木条伸入瓶中 |
B | 辨别H2 和CH4 | 分别点燃,在火焰上方罩一干冷烧杯 |
C | 证明燃烧的条件之一是可燃物与氧气接触 | 将白磷放入80℃热水中,不燃烧,通入氧气后白磷燃烧 |
D | 比较Fe、Cu、Ag的金属活动性 | 将Fe和Cu分别放入AgNO3溶液中 |
A.A B.B C.C D.D
9.除去下列物质中的少量杂质(括号内是杂质),所用试剂及办法均正确的是
A.铜粉(碳粉)——在空气中灼烧
B.氯化亚铁溶液(氯化铜)——加过量的锌粒、过滤
C.氢氧化钠(碳酸钠)——加适当的稀盐酸、蒸发
D.一氧化碳(二氧化碳)——通过足量的氢氧化钠溶液、干燥
10.为了除去物质中的杂质(括号内物质为杂质),操作办法不正确的是()
| 物质 | 操作办法 |
A |
| 在空气中充分灼烧 |
B |
| 加水溶解、过滤、蒸发 |
C |
| 加入足量 |
D |
| 气体通过灼热的铜粉或铜网 |
A.A B.B C.C D.D
11.下列所示图像能正确反应实验或化学反应事实的是
A. 稀H2SO4滴入BaCl2溶液中
稀H2SO4滴入BaCl2溶液中
B. 往部分变质的NaOH溶液中滴加稀盐酸
往部分变质的NaOH溶液中滴加稀盐酸
C. 等水平的Mg、Zn、Fe与足量的等水平分数的稀盐酸反应
等水平的Mg、Zn、Fe与足量的等水平分数的稀盐酸反应
D. 等水平,等水平分数的过氧化氢溶液制取O2
等水平,等水平分数的过氧化氢溶液制取O2
12.下列应用和相应的原理及基本反应种类正确的是
A.稀盐酸去除铁锈: 6HCl+Fe2O3===2FeCl2+3H2O 置换反应
B.用氢氧化镁治疗胃酸过多: Mg2+H2SO4=MgSO4 + 2H2O 中和反应
C.氢氧化钠做干燥剂: 2NaOH+CO2=Na2CO3+H2 O 复分解反应
D.铝制品耐腐蚀: 4Al+3O2=====2Al2O3 化合反应
13.离别、除杂、提纯和检验是化学实验的要紧环节,下面实验设计可以达到目的是( )
| 实验内容 | 实验设计 |
A | 除去氢气中少量的水蒸气、HCl | 先通过浓硫酸,再通过氢氧化钠溶液 |
B | 提纯久置变质的氢氧化钠溶液 | 先加入足量氯化钙溶液,充分反应后,过滤 |
C | 验证某溶液为稀盐酸 | 先测溶液的pH<7,再加入锌粒 |
D | 离别二氧化碳和一氧化碳混合物 | 先用足量氢氧化钠溶液吸收掉二氧化碳离别出一氧化碳,再向该氢氧化钠溶液加足量稀盐酸“释放”出二氧化碳 |
A.A B.B C.C D.D
14.下列实验不可行或不可以达到实验目的的是
选项 | 实验目的 | 实验办法 |
A | 区别NaCl溶液、FeCl3溶液 | 察看溶液的颜色 |
B | 去除粗盐中难溶性杂质 | 加水溶解、过滤、蒸发 |
C | 区别甲烷、一氧化碳、氢气 | 分别点燃后,检验燃烧产物 |
D | 辨别硝酸铵与氯化铵 | 分别取样,加固体氢氧化钙研磨,闻气味 |
A.A B.B C.C D.D
15.下列各组中的离子,能在溶液中很多共存的是
A.H+、K+、OH-、SO42- B.Ag+、Na+、Cl-、NO3-
C.Ca2+、Ba2+、 CO32-、NO3- D.Zn2+、Na+、SO42-、Cl-
2、填空题
16.共享单车( 自行车)因为符合“低碳出行”的理念,颇受青年的喜欢。
(1)“低碳出行”中“低碳”指的是较低的______气体排放;
(2)铁车架的表面刷油漆能预防锈蚀,其缘由是_______;
(3)用“共享单车”代替燃油汽车有哪些好处_________。
17.汽车和大家的平时生活密切有关,新型汽车制造很多用了金属、橡胶和复合材料。请依据所学常识和有关信息回答问题。
(1)制造汽车轮胎的橡胶是________(选填“天然有机高分子材料”或“合成有机高分子材料”)。
(2)为了节能、环保、安全,汽车身用的下列材料中,是复合材料的是_____。
A.镁合金 B.塑料
C.高强度钢 D.挡风玻璃(由无机玻璃、树脂、塑料等粘合而成)
(3)汽车轮毂一般用铝合金而不需要纯铝制造是什么原因_______。
(4)信息1、铝的化学性质非常活泼,但家用铝制品却极少出现腐蚀现象。
信息2、铜、铁、铝的某些物理性质:
性质 金属 | 导电性(100为标准) | 密度(g/cm3) |
铜 | 99 | 8.92 |
铁 | 17 | 7.87 |
铝 | 61 | 2.70 |
综合上述原因,常使用铝作为高压输电线,缘由是________(至少答出两点)。
(5)在氯化铜和氯化锌的混合溶液中加入适量的铁粉,充分反应后过滤,得到新的金属和滤液,滤液中肯定含有些溶质有________(填化学式)。
18.化学就在大家身边,它能改变大家的生活.请从“A 干冰B 肥皂水C 氢气D 石油E 不锈钢F 氢氧化钠G 氧化铁H 陶瓷I 铁强化酱油”中选择合适的物质填空(填字母).
(1)被叫做理想的“绿色能源”是_____;
(2)可用于人工降雨的物质是_____;
(3)用于制作医疗器械、炊具的是_____;
(4)被誉为“工业的血液”的是_____;
(5)可用于不同硬水和软水_____;
(6)铁锈的主要成分是_____;
(7)是一种要紧的无机非金属材料_____;
(8)防治缺铁性贫血_____.
19.初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:但凡有元素化合价升降的化学反应都是氧化还原反应。元素化合价升高的为还原剂,发生氧化反应;元素化合价减少的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,如此的反应称为氧化还原反应。请回答下列问题。
(1)依据化合价改变判断下列四种基本反应种类,肯定不是氧化还原反应的是_____。(选填序号)
A 化合反应 B 分解反应 C 置换反应 D 复分解反应
(2)下列化学反应中是氧化还原反应的是_____(选填序号),该反应的还原剂是_____(填化学式)。
A Na2CO3+CaCl2═CaCO3↓+2NaCl
B Fe+CuSO4═Cu+FeSO4
C Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
D CaO+H2O=Ca(OH)2
20.铁是现实日常用量最大的金属,写出符合下列需要的三个关于铁的化学方程式。
高炉炼铁的反应。_______________________
铁单质作反应物的置换反应。_______________________
清除铁锈的反应。_______________________
3、判断题
21.A、B、C、D、E、F都是初中化学中容易见到的物质,它们之间的相互转化关系如下:
若A、C组成元素相同,D为红色固体单质,写出A和B反应的化学方程式____。
若A、C组成元素相同,B中两种元素的水平比为21:8,D为能被磁铁吸引的黑色粉末,则:①E的化学式是____;F的化学式是 ____;
②A和B反应的化学方程式是____.
22.如图中的各物质及其转化关系,都与人类生产生活有密切关系。常温时 C、F、 G、M 均为气体,I 为液体,F、G 所含元素类型相同,F 的水溶液显酸性,E 为 难溶于水也难溶于稀硝酸的白色沉淀。
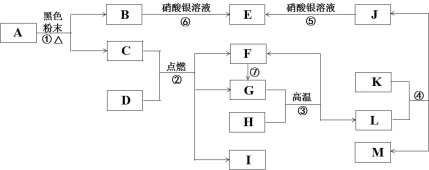
(1)写出反应①的化学方程式___________________________。
(2)反应③的化学方程式为___________________。
(3)组成物质 D 的元素为______________________________。
4、实验题
23.化学是一门以实验为基础的科学。请依据下列实验装置完成有关问题:
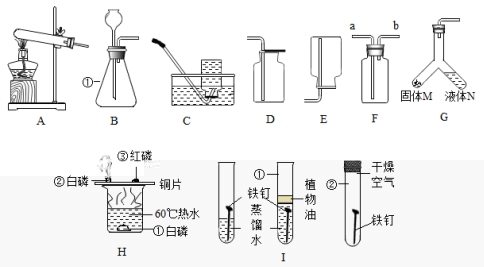
(1)写出B中标号①仪器的名字:_____,实验室用加热高锰酸钾制取氧气,发生装置可选择_____(填字母),反应的化学方程式是________,该装置有一处不足之处是_____;
(2)用装置F采集一瓶O2,验满时应将带火星的木条放在_____(填“a”或“b”)处;
(3)将装置G倾斜使两种药品混合,即可制得气体。下列制取气体的办法可使用装置G的是______;
A用锌和稀硫酸反应制取氢气
B加热无水醋酸钠和碱石灰的固体混合物制取甲烷
C用双氧水和二氧化锰反应制取氧气
D加热氯酸钾和二氧化锰的混合物制取氧气
(4)实验室用加热氯化铵和氢氧化钙固体混合物的办法制取氨气(已知:氨气密度比空气小,极易溶于水),则实验室制取氨气可使用的实验装置组合为______(填序号);
A A和D B A和E C B和E D A和F
(5)如图H所示,由“①处的白磷不燃烧、②处的白磷燃烧”的现象,说明可燃物燃烧需要满足的条件是______;
(6)I图是铁生锈条件的探究,一周后试管①、②中铁钉没有明显变化,说明铁锈蚀的过程,事实上是铁与空气中的_____发生化学反应的过程。
24.为了探究金属性质,某实验小组进行了如下实验:
(1)探究金属与酸反应的规律,某实验小组进行了如下实验:取等水平、同形状的铁片镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如图所示。
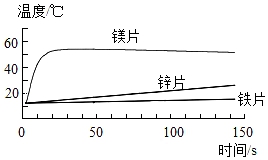
①请剖析反应中温度升高是什么原因:_______。
②依据曲线总结出金属活动性的有关规律_______。
(2)探究金属与某些盐溶液反应的规律,实验如下:向适量的硝酸银和硝酸铜混合溶液中渐渐加入锌粉。绘制的溶液中溶质类型与加入锌的水平关系如图所示。
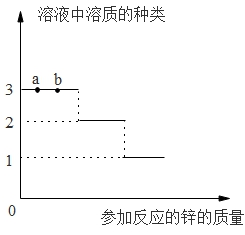
①向滤液中插入铁丝,铁丝表面没有明显变化,过滤后滤渣中的成分有______。
②a、b两点,溶液的水平a____b(填“=”、“<”或“>”)
5、计算题
25.为了测定混有杂质的石灰石样品中碳酸钙的水平分数,取20g样品加热,剩余固体的水平与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体水平/g | 20 | 20 | 17.8 | 15.6 | 13.4 | 13.4 |
在此测定过程中有两个时间段固体的水平都没改变,请问:
在t0至t1时间段,固体水平不变是什么原因______________________。
在t4至t5时间段,固体水平不变是什么原因______________________。
反应中产生二氧化碳的水平是________________。
通过计算求样品中碳酸钙的水平分数为____________________。
26.某化学小组的同学们对一份固体样品进行了探究.通过实验已确定该样品由氧 化铁和铁粉混合而成.他们取了 7.2g 固体样品,用图 1 所示的装置继续实验,测定的部分数据如图 2 所示。
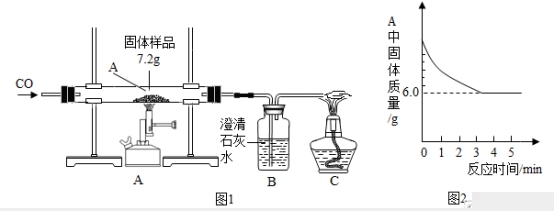
请计算:
(1)写出硬质玻璃管内的实验现象_____;
(2)该样品中含有氧化铁的水平为_____g;
(3)若澄清石灰水足量,反应结束后,装置 B 增重水平为多少?_____(写出具体计算步骤)
参考答案
1.B 2.B 3.D 4.C 5.C 6.C 7.D 8.C 9.D 10.B 11.B 12.D 13.D 14.D 15.D 16.二氧化碳 隔绝氧气和水 节省能源,不污染环境等
17. 合成有机高分子材料 D 合金的硬度大于组成它的纯金属 铝的导电性较好;耐腐蚀性能好;密度小(轻便);容易架设(答出两点即可) ZnCl2、FeCl2(填化学式)
18.C A E D B G H I
19.D B Fe
20.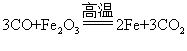 Fe+CuSO4=FeSO4+Cu Fe2O3+3H2SO4=Fe23+2H2O
Fe+CuSO4=FeSO4+Cu Fe2O3+3H2SO4=Fe23+2H2O
21.CuO+CO![]() Cu+CO2 C O2 4CO+Fe3O4
Cu+CO2 C O2 4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
22.2KClO3![]() 2KCl+3O2↑ Fe2O3+3CO
2KCl+3O2↑ Fe2O3+3CO![]() 2Fe+3CO2 肯定含有碳、氢,可能含有氧
2Fe+3CO2 肯定含有碳、氢,可能含有氧
23.锥形瓶 A ![]() 试管内导管口处未放一团棉花 b AC BD 与O2(或空气)接触 O2、水蒸气(或O2、H2O)
试管内导管口处未放一团棉花 b AC BD 与O2(或空气)接触 O2、水蒸气(或O2、H2O)
24.金属与酸反应放出热量 相同条件下,金属越活泼,与酸反应放出的热量越多(需要指明条件相同) 肯定有银和铜,可能有锌 >
25.刚最初加热,尚未达到石灰石分解的温度 石灰石已经完全分解 6.6 g 设碳酸钙的水平分数为x。
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
20 gx 6.6 g
![]()
x=75%
26.混合固体红色部分变黑色 4 3.3g







